1.摘要
本文综述了椎间盘退行性变的病理生理学、相关风险因素以及人类椎间盘的发育、结构、放射学和生物力学特性,为改善现有技术和开发创新技术以逆转椎间盘退行性变过程提供了重要的理解。
2.研究背景
椎间盘退变是导致慢性腰背痛的主要原因之一,由椎间盘内分解与合成过程失衡引起,最终导致髓核内容与水分的丧失、椎间盘高度下降。目前,大多数患者对保守治疗和手术干预初期反应良好,但依然有很多人遭受慢性腰背痛。因此,包括基因治疗、生长因子、细胞注射和组织工程构建在内的生物治疗引起了重视,它们有直接解决退行性变性问题的潜力。了解退行性椎间盘疾病的病理生理学对于改进现有技术和开发新技术,以逆转椎间盘的退变过程至关重要。
3.研究方法
论文采用的研究方法是文献综述。研究收集并分析当前文献中有关腰背痛(LBP)和腰椎间盘突出(LDH)的流行情况数据,探讨健康椎间盘的早期发展、结构和功能能力。此外,文章还讨论了退行性椎间盘疾病(DDD)的风险因素及其潜在病理机制,包括炎症、椎间盘营养改变和IVD基质的降解与重塑,这些因素最终影响了IVD的结构和生物力学功能。最后,文章还讨论了通过放射学如何观察到DDD所带来的有害变化,并与健康椎间盘相比较。
4.研究结果
1.椎间盘的发育、结构和功能
人类脊柱共有23个椎间盘,包括6个颈椎、12个胸椎和5个腰椎椎间盘,它们共占脊柱总高度的四分之一左右。椎间盘是位于两个相邻椎体之间的纤维软骨关节,每个椎间盘允许脊柱轻微的运动范围,包括轴向弯曲、压缩和旋转。椎间盘由三个解剖上不同的组成部分构成:凝胶状的髓核(Nucleus pulposus, NP)、围绕NP的同心纤维环(Annulus fibrosus, AF)层,以及软骨终板(Cartilaginous endplates, CEPs)。
2.椎间盘退变的风险因素
椎间盘退变的风险因素包括遗传、吸烟和肥胖。遗传对DDD的易感性估计在34%至61%之间;这一范围的变异性是由多基因参与和复杂的遗传模式所致。此外,肥胖被认为是DDD的风险因素,主要是由于椎间盘承受的加载力增加,加速了椎间盘的早期退化。吸烟的影响被假设是通过一氧化碳饱和血红蛋白引起的椎间盘细胞缺氧来实现的。
3.椎间盘退变的病理机制
椎间盘退变通常由椎间盘内部分解代谢和合成代谢过程的失衡引起。退行性过程的启动与多种风险因素有关,如遗传、吸烟和肥胖。椎间盘内过多的分解代谢过程导致细胞外基质发生剧烈变化,最终破坏椎间盘的解剖结构和正常功能。随着细胞外基质的降解,新生神经和新生血管的形成发生。此外,趋化因子的入侵激活了炎症途径,进而通过上调蛋白酶和基质金属蛋白酶(MMPs)的表达来加剧退行性过程。最终,这一级联反应导致椎间盘突出和髓核物质的丢失,随后导致椎间盘高度的丢失。理解导致DDD的复杂和众多机制对于设计新型治疗方法至关重要,如基于细胞的治疗,旨在不仅阻止DDD,还能逆转其破坏性影响并恢复椎间盘的完整性和生物力学功能。
4.放射学发现的健康和疾病椎间盘
椎间盘退变是由环境和遗传因素共同作用引起的,导致椎间盘发生形态学和生化变化。尽管临床表现与放射学结果的相关性较差,但诊断成像技术在椎间盘退变的评估中仍然发挥着重要作用。这些成像技术包括椎间盘造影术、放射成像和计算机断层扫描脊髓造影。然而,磁共振成像(MRI)是评估椎间盘病理的黄金标准。MRI允许对椎间盘退变的退化变化进行定性和定量分析,如椎间盘脱水、蛋白聚糖损失和胶原蛋白降解。此外,它还提供了有关椎间盘相关结构的详细信息,包括软骨终板、小关节、韧带和神经。在健康的人类椎间盘中,NP和AF在T1加权序列中与骨性椎体相比呈低信号强度。椎间盘退变通常表现为NP的T2信号强度丧失和椎间盘高度减少。在椎间盘退变的晚期阶段,可能会表现为由于AF细胞外基质的生化降解而导致的环状裂纹和椎间盘突出。
椎间盘退变的发病机制复杂,涉及多种风险因素和病理过程。本文综述了DDD的病理生理学基础、风险因素、以及当前和潜在的生物治疗方法,为临床医生和研究人员提供了一个全面的理解框架,以指导未来的治疗策略。通过深入理解DDD的病理生理学,我们可以更好地完善现有技术并开发创新技术,以逆转椎间盘的退行性过程。
全文翻译
腰椎间盘退行性变是慢性腰背痛的主要原因之一。退行性级联反应通常由椎间盘内分泌和外分泌过程之间的失衡引发。由于细胞外基质降解,新生神经和新生血管形成。最终,这种退行性过程导致椎间盘突出、髓核和水含量丧失以及随后的椎间盘高度减少。大多数患者最初对保守治疗和手术干预有良好反应,但仍有相当数量的患者持续遭受慢性腰背痛。由于长期退行性疼痛的高发生率,再生生物治疗,包括基因治疗、生长因子、细胞注射和组织工程构建物,在直接解决退行性过程方面引起了重视。了解退行性椎间盘疾病的病理生理学对于改进现有技术并开发创新技术以逆转椎间盘的退行性过程至关重要。在本综述中,我们旨在介绍退行性椎间盘疾病的潜在病理生理学,以及其相关风险因素,并全面总结人类椎间盘的发育、结构、放射学和生物力学特性。
1.前言
腰背痛(LBP)仍然是导致残疾的主要原因,这是根据2010年全球疾病负担研究中以失能调整生命年为单位进行测量的。其社会经济后果严重,仅在美国每年LBP的总间接和直接费用估计超过1000亿美元。腰椎间盘退行性变是慢性LBP最常见的原因之一,由于老龄化、肥胖、慢性压力、职业暴露和吸烟等危险因素的存在,其患病率正在上升。遗传学在发病机制中起着关键作用,并且退行性过程的进展通常是不可避免的。目前可用于治疗腰背痛和腰椎间盘突出(LDH)的方法包括物理治疗、止痛药物和手术干预,这些方法可以缓解患者的症状,但通常不能治疗椎间盘的潜在疾病。因此,生物治疗方法如基因治疗、生长因子、干细胞注射和组织工程方法近年来备受关注,因为它们有可能恢复退化的椎间盘的结构完整性和生物力学特性。然而,大多数这些治疗方法仍处于临床前阶段,只有少数方法已经进入临床试验阶段用于治疗退行性椎间盘疾病(DDD)。了解DDD的发病机制对于改进现有技术以及开发创新技术来逆转椎间盘退行性过程非常重要。在这篇综述中,我们根据当前文献提供的数据评估了腰背痛(LBP)和椎间盘突出(LDH)的患病率。我们还讨论了健康的椎间盘早期发育、结构和功能能力。此外,我们还讨论了DDD的危险因素以及导致DDD的病理机制——炎症、改变的盘营养和IVD基质降解和重塑,这些共同损害了IVD的结构和生物力学功能。最后,我们讨论了DDD引起的有害变化如何在病变椎间盘中通过放射学成像显示,并与健康盘进行对比。
2.腰背痛和椎间盘突出的患病率
一项2008年对全球腰背痛(LBP)患病率的系统综述显示,点患病率为11.9%(±2.0%),1年患病率为38.0%(±19.4%),终身患病率为39.9%(±24.3%)。只有少部分LBP病例可以归因于特定的病因,如肿瘤、骨质疏松、感染、骨折、结构畸形、神经根病变或马尾综合征,而85%的病例无法归因于特定原因。然而,退行性脊椎间盘变性(DDD)仍然是慢性LBP最常见的原因之一。2015年发表的一项系统综述与荟萃分析由Brinjikji等人展示了DDD的核磁共振成像(MRI)结果在LBP患者中比无症状个体更常见。然而,其他研究发现与高Pfirrmann分级或明显Modic改变一致的MRI结果与慢性LBP的强度或进展无关。因此,DDD的放射学发现与慢性LBP之间的直接关联仍不清楚。在DDD患者中,临床症状可能是由于椎间盘源性疼痛而产生的,而无需椎间盘突出和/或由于椎间盘膨出导致机械性神经压迫。LDH通常先于环纹裂隙出现,环纹裂隙是人类IVD退行性级联中环纤维环(AF)的细胞外基质降解引起的。然而,在早期DDD中也可以看到LDH,并通过促进髓核物质和水含量的丧失以及改变生物力学来加速退化。最初使用保守治疗方法来管理LDH病例,如非甾体抗炎药和物理治疗,因为这些方法可以为大多数患者提供缓解症状。此外,早期手术干预可能加重退化过程,并增加延迟发作的椎间盘源性疼痛等长期并发症的可能性。此外,一项多中心研究显示,在接受手术治疗的具有坐骨神经痛的LDH患者中,约三分之一在10年后仍存在持续的椎间盘源性LBP。由于长期椎间盘源性疼痛的高发生率,再生细胞疗法引起了广泛关注,这种疗法有可能直接解决退化过程。椎间盘再突出是腰椎间盘切除术后并发症的主要原因。一项基于12项研究、涉及1648名患者的2015年荟萃分析显示,腰椎间盘切除术后再次突出的发生率可高达21.2%。Keskimäki等人报道,在25359例患有腰椎间盘突出的手术患者中,总体9年累积复手术风险为18.9%。复发和再手术率以及临床结果可能受到LDH类型、大小和残余纤维环缺陷的特征以及手术干预类型是影响因素之一。Watters等人的研究表明,接受分离切除术的患者复发率较高,但临床结果较好。在另一项研究中,Carragee等人显示,在腰椎间盘切除术后出现大型纤维环缺陷的患者中,复发率为27.3%,再次手术率为21.2%。而在同一项研究中,出现小型环裂的患者只有1.1%的再次手术和复发率。基于这些累积结果,环形闭合装置和组织工程化环修复方法是降低再次突出率、促进纤维环组织结构和功能再生与恢复所必需的。
3.人类正常椎间盘的解剖
人类脊柱由23个椎间盘组成:6个颈椎盘,12个胸椎盘和5个腰椎盘,总共占据了脊柱高度的四分之一。椎间盘是位于两个相邻椎骨之间的纤维软骨关节。每个盘都允许脊柱进行轻微的运动,包括轴向弯曲、压缩和旋转。一个椎间盘由三个解剖学上不同的部分组成:髓核(NP)、纤维环(AF)以及软骨终板(CEPs)(图1)。
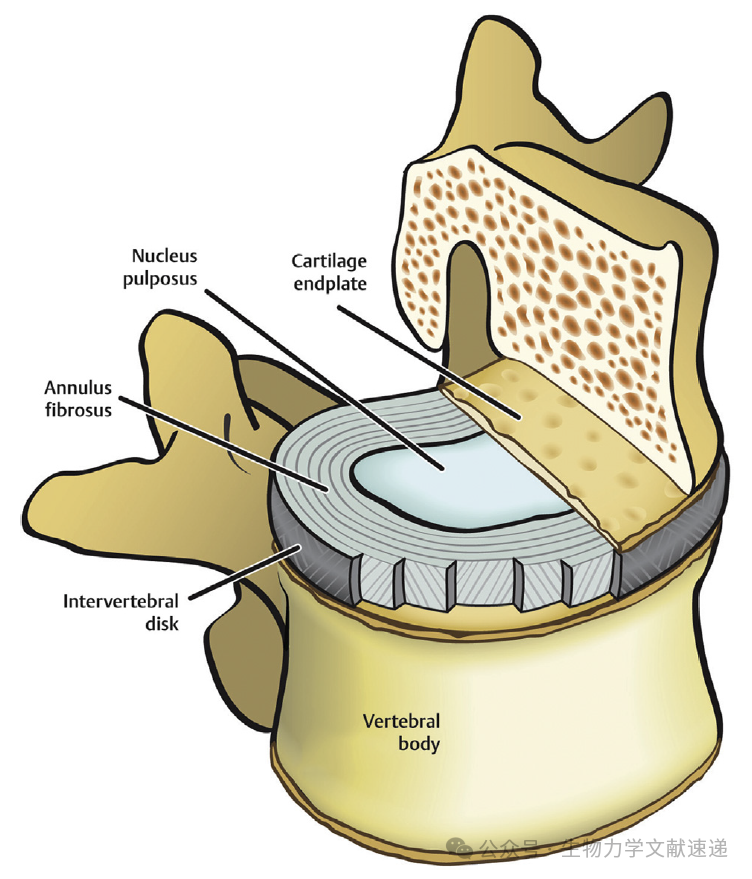
图1:
图1. 健康人腰椎间盘的解剖结构。内部由胶状髓核物质组成,外部由环状纤维组织构成的纤维环。位于尾部和头部的软骨终板支撑着椎间盘
人类脊柱的解剖组成部分来自于不同的胚胎起源,主要是中胚层体节的脊索和硬骨板。在原肠化之后,脊索位于胚胎的背部。脊索由中央位于周围纤维结缔组织包围的糖蛋白构成。然后,在发育的第四周,硬骨板细胞从中胚层体节迁移,形成椎体、椎间盘和环纤维。脊索的分段和硬骨板细胞的凝聚导致了NP核心和周围环纤维的形成。在发育的第六周,软骨化过程形成了软骨椎柱。这个柱子从发育第八周开始骨化,并持续到早期成年期。极度水合的凝胶状NP组织由低密度细胞组成,这些细胞最初来自于脊索,并在5岁时全部变成软骨细胞。脊索细胞的丧失在IVD的有限修复能力中起着重要作用。NP的细胞外基质主要由II型胶原和蛋白聚糖组成。NP中占主导地位的蛋白聚糖是聚集素,透明质酸吸引并保留水分,产生肿胀压力,有助于保持椎间盘高度,并在脊柱受压加载时帮助椎间盘充当减震器。此外,许多研究表明,NP中高浓度的蛋白聚糖导致椎间盘内没有神经内部化,这很可能是由于聚集素的负电荷硫酸盐基团。在年轻和健康的成年人中,NP和AF之间的边界是清晰的(图2)。AF是一个高度有组织的纤维软骨结构,包围着NP,其由2层组成:i)内部纤维环(AF),由于其与NP在圆形软骨细胞样细胞外形和基质组成上的相似性,与NP之间的边界不明显;ii)外部纤维环(AF),由大约15-20个斜向排列的I型胶原纤维构成,其中夹杂有蛋白酶分解物。外部纤维环由薄而延长的类似成纤维细胞的细胞组成。每个外部纤维环层由平行纤维组成,这些纤维按交替方向连续运行,这种排列方式在压缩加载期间赋予椎间盘张力强度,并防止NP物质外溢(图3)。
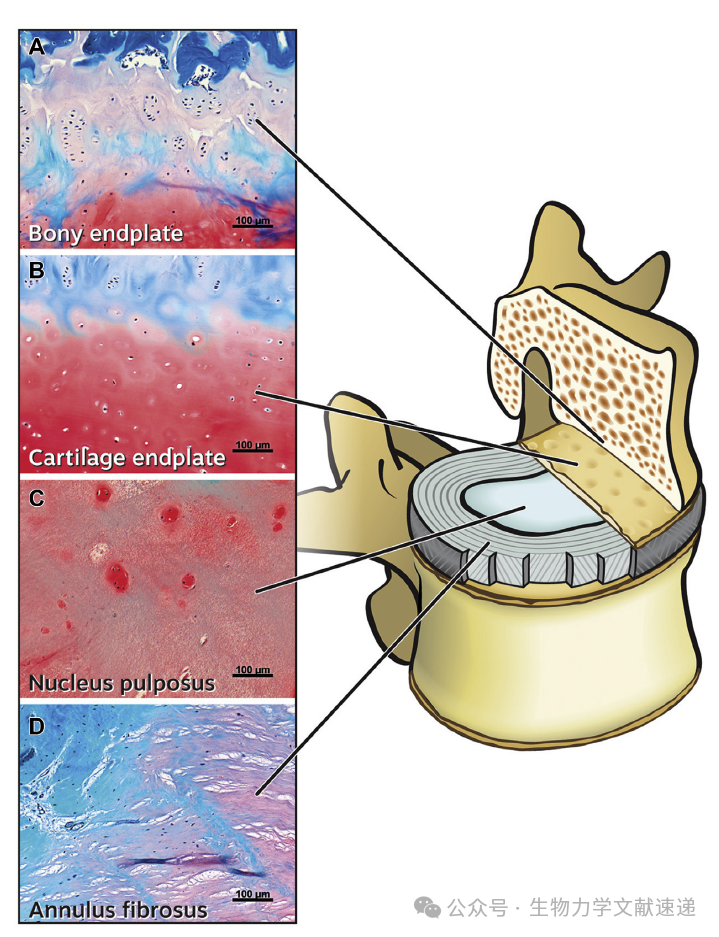
图2:健康人类腰椎间盘的组织结构。(A) 骨终板,(B) 软骨终板,(C) 椎间盘髓核,(D) 纤维环。骨终板明显可见,含有肥大的软骨。
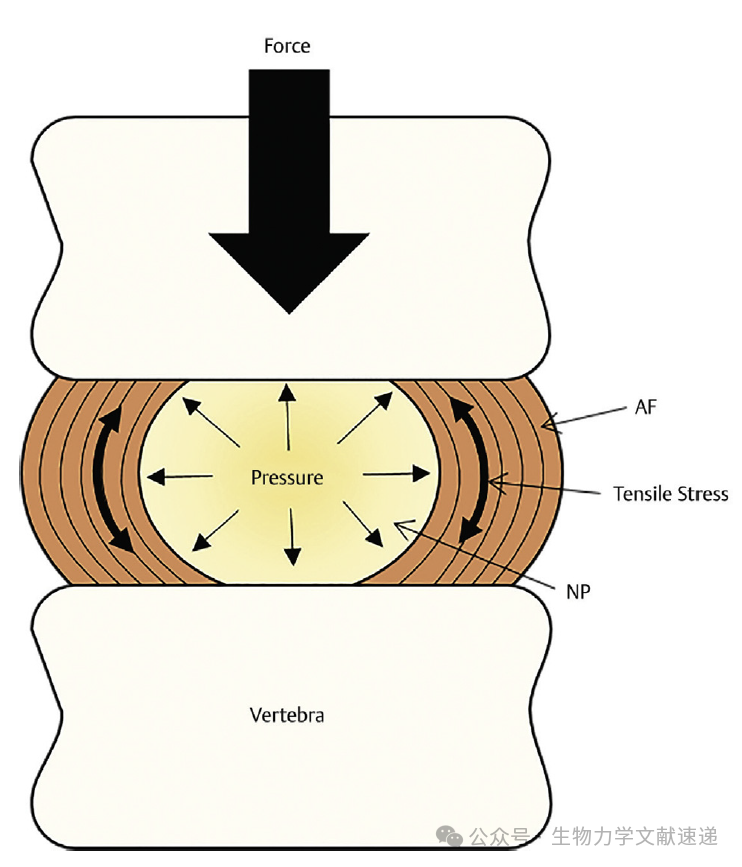
图3:在机械应力下,椎间盘经历了压缩、扭转和张力。纤维环(AF)和髓核(NP)提供弹性并保持椎间盘高度。髓核通过将压缩力通过周围的纤维环组织来抵抗压缩力。
最后,CEP完全覆盖了椎间盘的尾部和头部表面,并位于椎间盘和相邻椎体终板之间的中央位置。CEP含有丰富的II型胶原和软骨细胞,与身体中其他关节组织一样,并且它是椎间盘所有结构中细胞密度最高的。CEP将椎间盘连接到椎体,并通过其多孔性提供营养-废物交换。它由透明软骨组成,其厚度在椎间盘的外围大于中心。CEP的血液供应由前脊髓动脉的节段分支和基椎血管供应(图4)。在新生儿期和婴儿期,血管供应延伸到AF的内部部分。随着发育的进行,血管最终会收缩,在健康的椎间盘中,它们局限于CEP和最外层的AF。CEP的血管性是为提供营养和氧气至盘中至关重要的,并且这些物质通过CEP被动扩散到主要无血管的IVD。NP细胞位于离血液供应最远处,处于缺氧和酸性环境中。
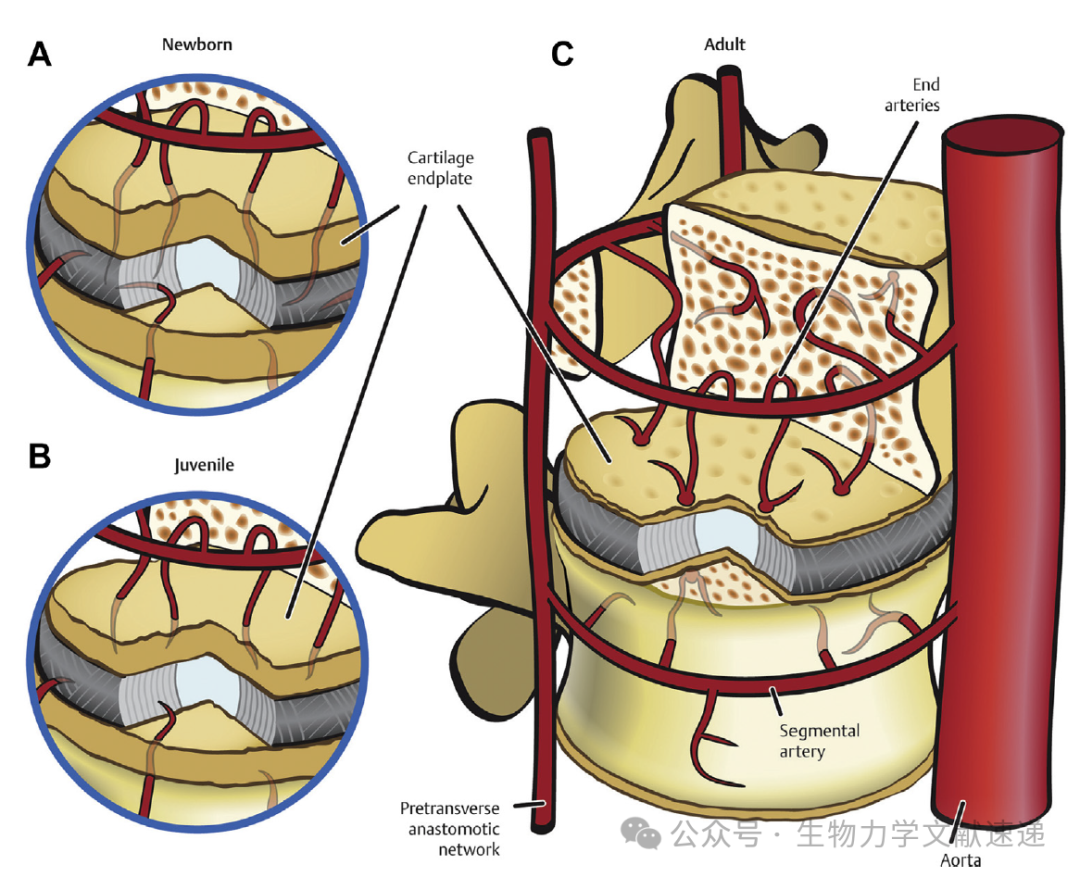
图4:(A)新生儿的椎体和椎间盘血管网络;血液供应可以延伸到纤维环(AF)的最内部区域。(B)在青春期,血管从盘中进一步向外部纤维环区域退缩。(C)在成年脊柱中,血管进一步退化远离纤维环,并固定在终板和结缔组织内外。脊柱椎体和椎间盘周围的动脉组织。血管在新生儿时延伸到最内部的纤维环(A),在青少年时退缩到外部纤维环(B),并在成年人的软骨终板上受限(C)。
与血管性相似,神经支配仅限于健康成年椎间盘的外部部分(图5)。在退变的椎间盘中,神经纤维向深入椎间盘生长主要是导致椎间盘源性疼痛的原因。
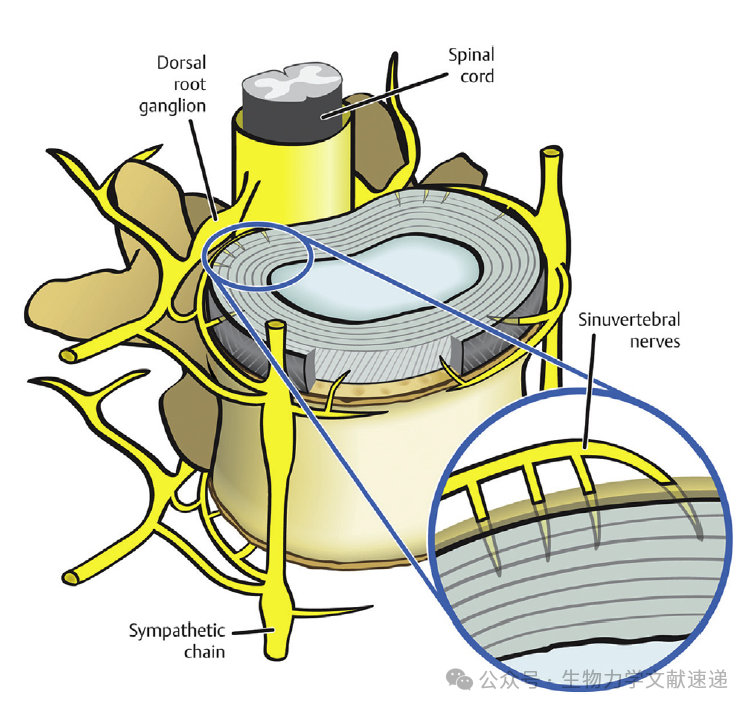
图5:人类椎间盘由韧带神经供应。在健康的椎间盘中,神经末梢只能延伸到纤维环最外层。
4.椎间盘退行性病理生理学
DDD通常是由于椎间盘内的分解代谢和合成代谢之间的不平衡而引起的。幼年椎间盘中的脊索细胞通过上调基质合成和下调蛋白酶等降解酶的表达来促进合成代谢过程。然而,这些细胞在早期就会丧失,从而使椎间盘易于早期退化。分解代谢过程开始占主导地位,引发了一系列降解过程。尽管DDD通常伴随着正常衰老,但它可以被多种风险因素加速,如遗传、吸烟和肥胖(图6)。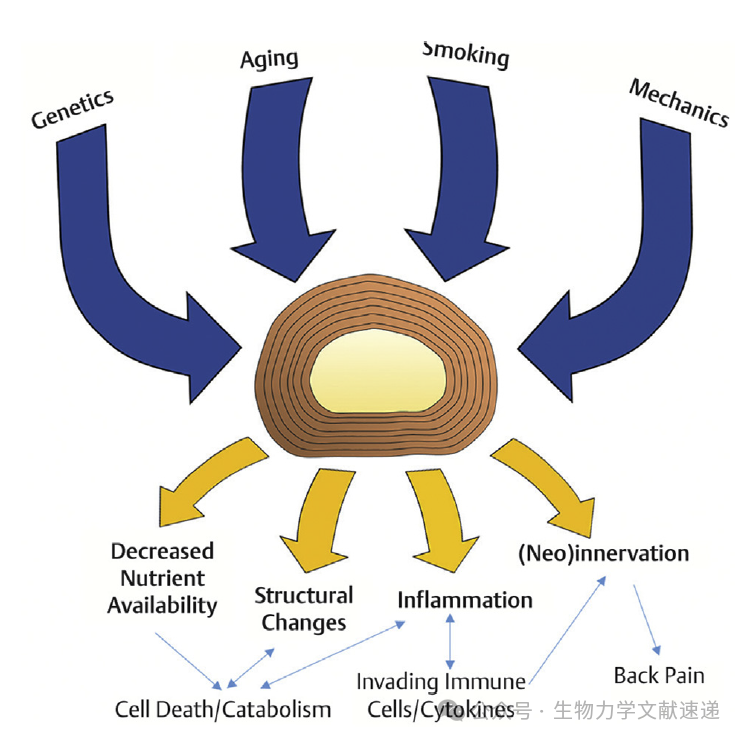
图6:参与退行性椎间盘疾病的风险因素和病理过程。DDD的遗传性估计在34%至61%之间;这个范围内的变异性是由多个基因和复杂遗传模式所造成的。此外,已经发现几个基因的突变和/或多态性与DDD的风险因素有关。生长分化因子5(GDF5)已被证明通过上调NP中蛋白聚糖和II型胶原合成来促进软骨生成。然而,研究还表明GDF5通过炎症细胞因子信号通路可以促进IVD的细胞外基质降解。GDF5基因的多态性以及编码基质金属蛋白酶(MMPs)、维生素D受体和I型胶原(COL1A1)的基因都与DDD有关。此外,聚集素(ACAN)基因的多态性引入了结合硫酸软骨素分子数量和聚集素蛋白链长度的变异性,这可能对椎间盘保水能力、产生肿胀压力以及抵抗和消散压缩力的功能产生负面影响。此外,环氧合酶-2的多态性——一种参与前列腺素生物合成途径的酶——也与DDD及其伴随的椎间盘源性疼痛有关。所有这些多态性共同导致DDD,并被视为可能的基因治疗靶点进行研究。肥胖被认为是DDD的一个风险因素,主要是由于椎间盘承受的负荷增加,增加了椎间盘早期退变的倾向。Solovieva等人观察到遗传和肥胖作为DDD风险因素的协同效应,发现那些既有既往肥胖(体重指数[BMI]>30)又有COL9A3基因多态性的患者,其椎间盘显示出1)高度减少和2)MRI信号减少。与正常BMI的人相比,肥胖人群的强度较高。此外,一项涉及青少年和年轻成年人(13至20岁)的研究显示,在肥胖、超重、正常和体重不足等不同类别中,存在强烈的正相关关系。BMI与DDD严重程度之间的关联。这些研究的结果可以归因于高BMI者椎间盘的更大压缩负荷以及炎症风险增加,因为存在体重超过正常范围(BMI >25)的个体血清中瘦素和炎症信号分子(如白细胞介素-6、C-反应蛋白和肿瘤坏死因子-α)的水平显著增加。炎症活性的增加导致了椎间盘内稳态的紊乱,并最终促进了退行性椎间盘疾病(DDD)的进展。长期以来,已经知道炎症在DDD的发生和传播中起着关键作用。 一旦开始,炎症在盘片内引入了一个有害的反馈循环,在这个循环中,侵入免疫细胞产生细胞因子和趋化因子,不仅招募更多免疫细胞进入椎间盘,还上调基质降解酶的表达。退变椎间盘中表达的细胞因子随后激活IVD中的蛋白酶酶(如MMPs和ADAMTS)。炎性细胞因子TNF-α的上调表达已被证明是激活聚集素酶ADAMTS-4和ADAMTS-5的原因。 然而,在这两种酶中,ADAMTS-4对DDD的作用更为显著。 根据Wang等人的研究,抑制TNF-α的作用可以恢复IVD的结构完整性。炎性细胞因子白细胞介素-1的拮抗剂也被发现可以减轻DDD对IVD的影响,但与TNF-α相比,其效果更大。DDD的另一个风险因素是吸烟。其作用被假设是通过IVD细胞中一氧化碳饱和血红蛋白引起的缺氧来发生的。在对人类IVD进行的一项体内研究中,放射学结果比较显示,暴露于香烟烟雾中会诱发退化并加重已存在的DDD。与未暴露于烟雾的组相比,暴露于香烟烟雾中的椎间盘MRI信号强度显著降低,并且盘高度减小。此外,Akmal等人进行的一项体外研究使用含有不同浓度尼古丁的培养基培养牛细胞,结果显示,在3周后,椎间盘退变程度与尼古丁浓度呈正相关。此外,在尼古丁暴露的IVD中还观察到了从II型胶原向I型胶原明显转变的现象。吸烟者DDD严重程度明显增加至少部分归因于对CEP血管血流抑制;同时也假设部分归因于肌碱能受体激活。在慢性吸烟小鼠模型中,Wang等人发现了吸烟在DDD中的重要作用。与未暴露于烟雾的对照组相比,暴露于烟雾中的小鼠椎间盘中蛋白聚糖含量显著降低,蛋白聚糖和胶原合成减少,并且硫酸软骨素降解显著增加。暴露于烟雾中的小鼠NP组织中衰老细胞的比例是未暴露小鼠NP组织的两倍。激活凋亡途径与DDD进展程度有关:内质网凋亡途径在早期阶段活跃,死亡受体途径在晚期阶段活跃,最后,线粒体途径在DDD的严重阶段活跃。了解适时、活跃的凋亡途径对于设计能够抑制椎间盘细胞耗竭以停止椎间盘退行性过程的干预措施是有用的。早期椎间盘退变发生的生化变化涉及蛋白聚糖的降解,随后是不同椎间盘结构中胶原类型的逐渐转变。 聚集素是在NP和内部AF的细胞外基质中发现的主要蛋白聚糖,它负责在压缩加载过程中产生对消散轴向力有用的IVDs肿胀压力。聚集素降解导致椎间盘脱水是其主要后果,因为聚集素中亲水性和保水性较强的硫酸软骨素会减少。此外,在NP失去聚集素后,曾经无神经元的椎间盘开始出现新神经化。结构上,椎间盘脱水导致整体高度减少,并且随着NP中II型胶原被I型胶原取代,刚度增加。因此,在重复加载下,退变椎间盘的生物力学能力受到损害,并且随着时间推移,微观结构损伤累积并最终可能表现为AF组织撕裂。 在DDD进展过程中,外部AF的同心层片发生了从纤维性I型胶原到软骨性II型胶原的变化,这对AF的结构完整性以及其抵抗拉力的能力产生了负面影响,可能导致NP物质脱出椎间盘。 椎间盘突出导致相邻神经根受压,并且在临床上可能表现为根性神经病变。无论是否伴有盘源性疼痛,布朗等人发现,与健康的椎间盘相比,神经肽物质P在退变和疼痛的成年椎间盘中显著更丰富。一个健康的成年人的椎间盘(IVD)主要是无血管和无神经的,血管和神经仅限于外部纤维环(AF)和终板内皮细胞(CEPs)。在外纤维环之外,更深入到椎间盘内部,营养物质和氧气通过被动扩散到达内部纤维环(AF)和髓核(NP)。然而,在退化椎间盘患者中,相关的终板内皮细胞(CEPs)在放射学上被观察到发生结构变化,如增加了终板和小梁的骨化和多孔性,这可能会影响将必需营养物质输送到椎间盘的运输效率。结果是,在IVDs内形成缺氧环境迫使椎间盘细胞进行厌氧代谢以满足其能量需求。持续的缺氧和糖酵解导致代谢产物乳酸积累,最终导致椎间盘pH下降。研究评估降低pH以模拟IVDs中营养物质运输不高效的影响发现,最终导致椎间盘细胞的死亡。随着时间的推移,随着软骨老化和细胞凋亡,椎间盘软骨营养不良也导致了完整性的丧失,从而限制了其生物力学功能。对压缩力的弹性降低和损伤反过来又延续了退行性过程。作为对退行性诱导的软骨重塑以及由于营养物质运输不效率引起的代谢需求增加的响应,新血管生成和新神经化同时发生,这些特征区分了患病椎间盘状软骨与健康椎间盘状软骨。
5.健康和疾病椎间盘的放射学发现
椎间盘退变是由环境和遗传因素的综合作用引起的,它导致了椎间盘形态和生化学变化。尽管临床表现与放射学结果之间存在较差的相关性,但诊断成像技术仍在评估椎间盘退变中起着重要作用。这些成像技术模态包括椎间盘造影、放射学和计算机断层扫描髓造影。然而,磁共振成像(MRI)是评估椎间盘病理的黄金标准成像模态。MRI允许对椎间盘退行性变化进行定性和定量分析,如椎间盘脱水、蛋白聚糖丢失和胶原蛋白分解。此外,它还提供了与椎间盘相关的其他结构的详细信息,包括终板、小关节、韧带和神经。因此,有效解读磁共振图像对于整体临床评估椎间盘至关重要。在健康的人类椎间盘中,无论是NP还是AF,在T1加权序列上与骨质椎体相比都呈低信号。NP和AF的内部部分在T2加权图像上最为明显。椎间盘退变通常表现为NP的T2信号强度降低和椎间盘高度减小。在进展阶段,椎间盘退变可能会表现为环状裂纹和椎间盘膨出,这是由于AF细胞外基质的生化降解所致。T2映射序列提供了关于椎间盘脱水和蛋白聚糖丢失的更详细信息。Pfirrmann等人描述了一种最常用且可靠的MRI分级系统,用于评估椎间盘退变。Pfirrmann分级提供了关于IVD中矢状T2加权MR图像定性特征的定量值。这些特征包括IVD形态的均匀性、AF和NP边界的区分、T2信号强度和椎间盘高度。Modic等人引入了一个分类系统,用于分析与椎间盘退变相关的CEP的T1加权和T2加权信号强度变化。尽管Modic变化对于椎间盘源性腰痛具有很高的特异性,但敏感性较低。超短TE(回波时间)和扩散张量成像等影像学技术可以评估椎间盘中胶原纤维排列的微观变化,对于早期DDD的评估显示出潜力,并值得进一步研究。
6.结论
脊椎间盘退行性变性疾病(DDD)的发生是由于脊椎间盘内分解和合成过程之间微妙平衡的破坏,而这种破坏可能受到多种因素的加速,包括正常衰老、肥胖和吸烟。椎间盘中过多的分解代谢过程导致细胞外基质发生剧烈变化,最终损害了解剖结构和正常功能。由于细胞外基质的降解,新的神经和血管化进入。此外,趋化因子侵入椎间盘激活炎症途径,进而通过上调聚集素酶和基质金属蛋白酶的表达来延续退行性过程。最终,这一级联反应导致椎间盘突出、髓核物质丧失及随后的椎间盘高度减少。了解导致退行性椎间盘疾病的复杂而多样的机制对于设计细胞治疗等新疗法至关重要。其目的旨在不仅停止DDD,还要逆转其破坏性影响,并恢复IVD的完整性和生物力学功能。
来源:生物力学文献速递
温馨提示:本平台分享健康图文信息,仅供大家参考,不作为医疗诊断依据。如有需要,请在医师指导下使用。此公众号所转载的所有文章、图片、音频视频文件等资料版权归版权所有人所有,因非原创文章及图片等内容无法一一和版权者联系,如原作者或编辑认为作品不宜上网供大家浏览,或不应无偿使用,请及时通知我们,转载此文是出于传递更多信息之目的,本文无意侵犯媒体或个人的知识产权,若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本公众号联系,我们将及时更正、删除






